华海药业冲击10亿美元品种 抗痛风药可在美销售
- 2022-04-07 11:48:36 医药网
- 独家
4月1日,华海药业公告称,公司向FDA申报的左乙拉西坦注射液、非布司他片的ANDA已获得批准,截至公告日,华海药业在上述两款产品已投入研发费用分别约598万元、1430万元。米内网数据显示,今年以来,华海药业获得FDA批准的ANDA已达5个。
左乙拉西坦注射液是由UCB研发的一款抗癫痫药,最早于2006年在美国上市,2021年优时比的左乙拉西坦全球销售额达9.7亿欧元(以4月1日汇率计,约10.7亿美元)。目前在美国境内,左乙拉西坦注射液的主要生产厂商包括Viatris、Aurobindo、Hikma等。
而在国内市场,华海药业于2020年11月以仿制4类提交左乙拉西坦注射用浓溶液上市申请,近日已步入行政审批阶段,有望于近期获批。
非布司他片是由Tekeda研发的一款黄嘌呤氧化酶抑制剂,主要用于痛风患者高尿酸血症的长期治疗。原研产品最早于2009年3月在美国上市,目前在美国境内,非布司他片的主要生产厂商有Viatris、Sun、Alembic等。
华海药业的非布司他片ANDA于2018年5月获得FDA暂时批准,此次为正式获得批准。而在国内市场,华海药业曾于2014年提交非布司他片上市申请,之后主动撤回,目前还处于开展BE试验阶段。
华海药业表示,左乙拉西坦注射液ANDA文号的获批及非布司他片获得正式批准,标志着公司具备了在美国市场销售上述产品的资格,这有利于公司不断扩大美国市场销售,强化产品供应链,丰富产品梯队,提升公司产品的市场竞争力,对公司的经营业绩产生积极的影响。
2022年至今华海药业获批的ANDA
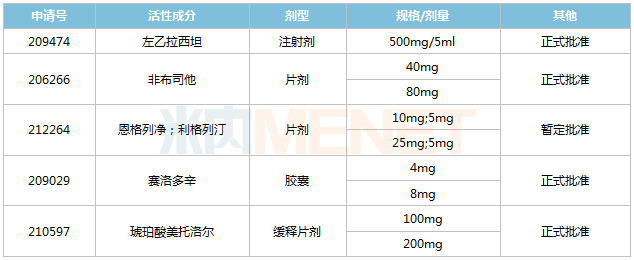
来源:米内网全球上市药物库
米内网数据显示,含左乙拉西坦、非布司他在内,今年以来华海药业已有5个ANDA获得FDA批准,其中恩格列净利格列汀为暂定批准。
来源:米内网数据库、上市公司公告等
注:数据统计截至4月1日,如有疏漏,欢迎指正!

本文地址:http://www.bx9y.com/dujia/2022-04-07/581010.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 黑龙江新增本土确诊病例10例 新增本土无症状感染者237例2022-11-17 18:00:32
- 河北新增无症状感染者263例2022-11-17 18:00:32
- 山东新增本土确诊病例16例、本土无症状感染者151例2022-11-17 18:00:31
- 31省份新增本土确诊病例2328例、本土无症状感染者20804例2022-11-17 18:00:31
- 明年迎来1158万毕业生 教育部多举措促就业2022-11-17 18:00:31
-

 灵活就业人员社保缴费怎么交?2022年灵活就业人员社保缴费多少钱?
灵活就业人员社保缴费怎么交?2022年灵活就业人员社保缴费多少钱?
2022-06-13
-

 五险一金多少钱?五险一金缴费标准是多少?
五险一金多少钱?五险一金缴费标准是多少?
2022-07-01
-
2022年社保缴费基数六个档次是什么?每个月扣多少钱
2022-06-30 15:21:11
-
7类人不用隔离14天 原来这些人不用集中隔离
2022-05-06 11:19:41
-
2022年五险一金缴费标准最低是多少?五险一金一个月大概交多少钱?
2022-08-11 09:40:26
-
境外人员回国隔离新规2022:具体需要隔离几天?回国隔离新规放松!
2022-07-01 15:01:46
-
2022中国首富是谁排名第一 来揭晓答案
2022-05-09 15:20:17


