华东医药爆款来袭!43个创新药及生物药超亮眼
- 2022-08-23 10:30:16 医药网
- 独家
华东医药近日发布了今年上半年的成绩单,营业收入182亿元,净利润超过13亿元。近几年国内药企巨头均在加速转型,华东医药从仿制走向创新、从国内走到国际,综合化转型的成果备受市场瞩目。2022年上半年,公司的医药工业板块研发支出超过5亿元,同比增长34%,目前公司医药在研项目合计86个,其中创新药及生物药项目达43款;3大重磅产品有望在年底前获批,入局抢食两大千亿市场。
创新驱动已成为国内药企发展的新方向,华东医药以“自主研发+合作委托开发+产品授权引进(License-in)”相结合的模式开展新药研发,聚焦内分泌、肿瘤及自身免疫三大核心治疗领域。米内网数据显示,2021年三大终端6大市场(统计范围详见本文末)消化系统及代谢药、抗肿瘤和免疫调节剂两个大类的销售规模均已超2000亿元。
扎根糖尿病用药市场!创新药聚焦热门靶点,两大新品即将获批
糖尿病用药市场是华东医药深耕近20年的领域,积累了良好的品牌效应和市场基础,2021年在中国城市公立医院、县级公立医院、城市社区中心及乡镇卫生院(简称中国公立医疗机构)终端糖尿病用药企业TOP20中,中美华东排名第九。公司的复方降糖药吡格列酮二甲双胍片近几年呈高速增长态势,2019-2021年增速分别为153%、60%、65%,2021年在中国公立医疗机构终端的销售额已超过7亿元,成为公司在糖尿病用药市场最畅销的产品。
图1:中美华东报产并在审的糖尿病用药仿制药

来源:米内网新版数据库
卡格列净片是一款SGLT2抑制剂,原研药于2017年进入国内市场,2019年起国产仿制药陆续上市,目前已形成“1原研+4国产”的企业格局,竞争态势相对缓和,该产品现为全国医保目录乙类品种,2021年在中国公立医疗机构终端销售额超过2亿元。中美华东于2021年1月提交仿制上市申请,公司预计可在今年年底前获批,有望成为公司首款SGLT2抑制剂,进一步强化公司在糖尿病用药领域的竞争实力。
华东医药近几年针对糖尿病临床主流治疗靶点,形成了创新药和差异化仿制药产品管线的全面布局,其中GLP-1类创新药及生物类似药的在研品种众多,除了在国内开展临床,部分新品在海外的研发进度也非常顺利。
GLP-1类产品相对安全,是在肥胖或超重领域相对成熟稳定和安全的靶点,近几年在中国公立医疗机构终端糖尿病用药市场,GLP-1受体激动剂的市场规模正在快速扩大,最近三年以59%、42%、68%的增速快速成长,市场潜力巨大。
表1:华东医药内分泌领域主要创新药及生物类似药研发进展
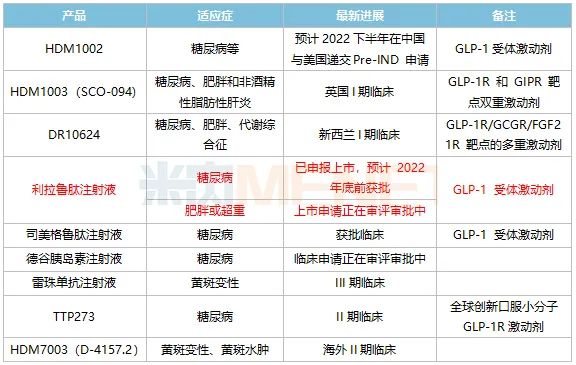
来源:公司半年报
华东医药在研的GLP-1类创新药也有涉及双靶点、多靶点等全球最热的研发方向,其中HDM1003(SCO-094)、DR10624目前分别在英国、新西兰进行I期临床。此外,TTP273是一款全球创新口服小分子GLP-1R激动剂,目前正在II期临床阶段,公司在2019年以3900万美元授予韩国Daewon公司该产品在韩国的独家开发、生产及商业化权益,这是华东医药首个License-out的产品。
生物类药方面,备受市场关注的国内首款利拉鲁肽注射液上市在即,中美华东在2021年9月首家提交3.3类上市申请(糖尿病适应症),公司预计今年年底前获批;此外,公司在今年7月还首家提交了该产品肥胖或超重适应症上市申请,公司有望成为国内首家拿下利拉鲁肽生物类似药两个适应症的企业。
图2:诺和诺德的利拉鲁肽两个适应症全球销售情况(单位:百万丹麦克朗)
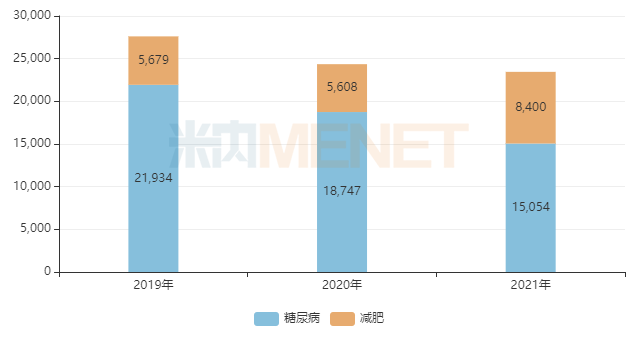
来源:米内网跨国上市公司销售数据库
目前,诺和诺德的利拉鲁肽减肥适应症的销售规模已超过84亿丹麦克朗(即时汇率换算,约11亿美元),2021年增速接近50%,减肥适应症的销售额占比上升至35%以上,市场潜力不容小觑。
数据显示,截至2019年我国18岁以上超重及肥胖人口规模达到1.92亿人,预计在2025年减肥药市场有望超过120亿元。CDE于2021年发布的《体重控制药物临床试验技术指导原则》提到我国目前仅有奥利司他胶囊一种药物获批用于肥胖或体重超重患者的治疗,合规、安全及有效的体重控制药物存在巨大未被满足的临床需求。
华东医药在半年报中提到,公司的奥利司他胶囊在市场上已拥有一定地位,若利拉鲁肽注射液减肥适应症获批,有望实现临床和院外市场的协同互补,截至目前,公司在利拉鲁肽注射液项目(含肥胖或超重适应症、糖尿病适应症)的研发投入超过2.8亿元。
免疫抑制剂龙头药企!拳头品种开发新剂型,重磅生物类似药即将报产
在中国公立医疗机构终端免疫抑制剂市场,中美华东从2017年起稳坐冠军宝座,公司的他克莫司、吗替麦考酚酯、环孢素2021年合计销售额超过40亿元。
他克莫司是一种强力的新型免疫抑制剂,2021年在中国公立医疗机构终端销售额超过50亿元。华东医药目前是他克莫司胶囊的国内领军企业,2021年市场份额超过41%。公司于今年4月提交了他克莫司软膏的仿制上市申请,公司表示预计今年还将提交他克莫司颗粒的仿制上市申请,进一步丰富公司他克莫司系列产品线。目前他克莫司软膏的竞争格局为“1原研+9国产”,而他克莫司颗粒暂未有国产仿制药获批或报产。
表2:华东医药自身免疫领域主要创新药及生物类似药研发进展
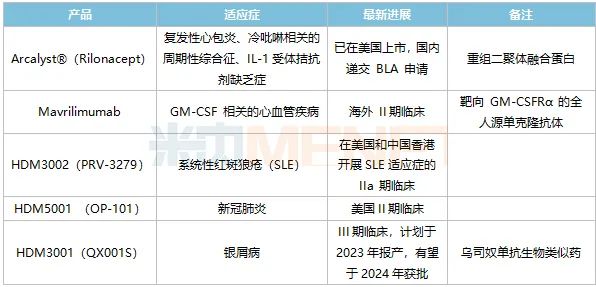
来源:公司半年报
Arcalyst®(Rilonacept,利纳西普)目前已在美国获批上市,获批的适应症为冷卟啉相关的周期性发热综合征(CAPS)、IL-1受体拮抗剂缺乏症(DIRA)、复发性心包炎(RP)。国内的CAPS、DIRA属于较为罕见的适应症,患者人数较少,但RP适应症在中国的患者人数相较更多。早前,Rilonacept被列入《临床急需境外新药名单(第一批)》,用于治疗冷吡啉相关的周期性综合征,华东医药表示将全力推进这款产品在中国的注册上市。
HDM3001(QX001S)是乌司奴单抗生物类似药,用于治疗成年中重度斑块状银屑病,其Ⅲ期临床试验已于今年2月提前完成全部受试者入组,华东医药计划在2023年报产,有望于2024年获批。乌司奴单抗于2021年谈判成功,进入国家医保目录,销售额有望迎来新一波涨潮。
猛攻抗肿瘤药市场!打造ADC全球研发生态圈,首个口服抗癌药来了
近几年,ADC药物的全球研发异常火热,预计2026年全球ADC药物市场规模将超过160亿美元。ADC药物通过连接子将抗体和毒素偶联,集抗体的特异性和毒性小分子的高抗肿瘤活性于一体,有望实现对肿瘤细胞的精准高效杀伤,被誉为肿瘤治疗“生物导弹”。
华东医药正不断围绕ADC领域进行布局,通过投资、控股、孵化多家国内拥有领先技术的生物科技公司,储备了较强的ADC研发技术积累。公司表示,未来将形成华东医药独有的ADC全球研发生态圈,持续开发差异化的ADC创新药物,计划在三年内立项开发不少于10款ADC创新产品并积极推动临床注册研究。
表3:华东医药在肿瘤领域主要创新药及生物类似药研发进展
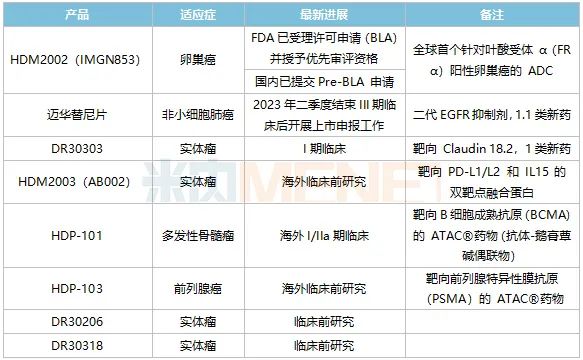
来源:公司半年报
HDM2002(IMGN853)是全球首个针对叶酸受体α(FRα)阳性卵巢癌的ADC在研药物,目前该产品已在美国递交了生物制品许可申请(BLA)并获得了优先审评资格。据悉,IMGN853还在开发多个联合疗法,包括与贝伐珠单抗、卡铂等,可以进一步提高卵巢癌的响应率。
1.1类新药迈华替尼片属于第二代不可逆EGFR抑制剂,局部晚期或转移性非鳞非小细胞肺癌适应症的III期临床正在进行中,华东医药预计在2023年二季度开展上市申报工作。国内已上市的二代EGFR抑制剂以阿法替尼为代表,2021年在中国公立医疗机构终端销售额已超过5亿元,有市场预测迈华替尼片上市后有望成为超10亿元级别产品。
图3:中美华东报产并在审的抗肿瘤药仿制药

来源:米内网新版数据库
甲苯磺酸索拉非尼片是拜耳的重磅抗肿瘤药,在国内上市多年,2020年起才有国产仿制药获批上市,现为2021版国家医保目录乙类品种,竞争格局是“1原研+4国产”,竞争态势未算激烈,该产品2019年在中国公立医疗机构终端销售额达到峰值13亿元。中美华东在2021年提交了甲苯磺酸索拉非尼片的仿制上市申请,公司预计今年年底前获批。目前公司已获批的抗肿瘤药仅有注射用地西他滨和注射用奥沙利铂,若甲苯磺酸索拉非尼片顺利获批,有望成为公司首个口服抗肿瘤药。
医药BD合作大展拳脚,2023及2024年将迎丰收期
华东医药成功向创新药企转型,不可不提公司的医药BD(商务拓展),前文提到的部分重磅创新药均为公司通过医药BD拿下的成果。
表4:华东医药2022年上半年部分医药BD合作开展情况
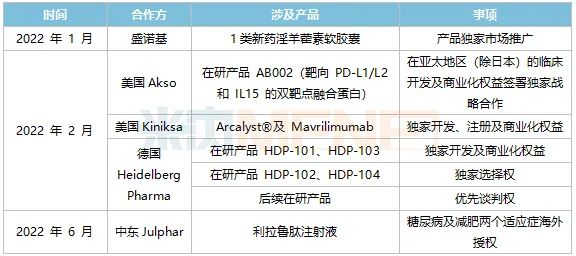
来源:公司半年报
2月,华东医药先后三次出手,引入美国Akso的抗肿瘤创新药AB002、美国Kiniksa公司的2款自身免疫领域新药Arcalyst和Mavrilimumab,再认购德国药企Heidelberg Pharma公司35%股权,加码ADC领域,该项收购所需的批准或核准已于近日完成。重金之下,公司的创新药矩阵不断丰盈。
6月,中美华东与Julphar达成战略合作,实现了利拉鲁肽注射液糖尿病及减肥两个适应症的首次“出海”,这是继TTP273后公司第二个海外授权产品,标志着公司糖尿病领域实力及研发创新能力再次得到国际认可。
据悉,在今年的中报业绩交流会上,公司管理层提到,往年华东医药更为关注的尽可能使药物管线更为丰富,而今年在策略上会有所转变,将更偏向于接近上市或已上市的产品,有望成为公司2023年、2024年业绩新的增长点。

本文地址:http://www.bx9y.com/dujia/2022-08-23/613784.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理









