信达生物拿下8个重磅新品 37款新药来势汹汹
- 2023-02-11 10:33:17 医药网
- 独家
近段时间,信达生物研发动态频发:PI3Kδ抑制剂帕萨利司申报上市、ADC新药IBI343启动I期临床......目前信达生物有37款新药(34款1类新药)处于获批临床及以上阶段,11款1类新药领跑双抗黄金赛道,CAR-T产品上市在即,首款自主研发的ADC药物亮相。非1类新药中,3个重磅单抗紧盯$90亿市场。
信达生物是国内为数不多的具有自主造血能力的创新药企。据公司公告,2022年前三季度信达生物总产品收入超过30亿元。目前信达生物已有8款产品获批,公司预计在未来4-5年内营业收入达到200亿元。
日前,2022年全国医保目录调整工作落下帷幕,信达生物有5款产品(含新增适应症)成功纳入新版全国医保目录,其中信迪利单抗在原基础上新增两项适应症(胃癌和食管癌),成为唯一将五大高发瘤种一线治疗纳入国家医保的PD-1;奥雷巴替尼通过谈判首次纳入国家医保目录,填补了携T315I突变CML患者治疗的空白;贝伐珠单抗、利妥昔单抗、阿达木单抗新增多项适应症,受益患者群体不断扩大。
11款1类新药领跑双抗黄金赛道
双抗药物通过细胞融合、重组DNA、蛋白质工程等技术制备,同时或先后特异性结合2种抗原或同一抗原的两个不同表位,理论上可以发挥“1+1>2”的作用,逐渐成为创新药研发和投资的“新宠”。
目前已有超30家国内药企布局双抗药物研发,其中信达生物为领跑者,有11款1类新药处于I期临床及以上阶段,涉及PD-(L)1、CD47、HER2、Claudin18.2、TIGIT等热门靶点,适应症集中在抗肿瘤及眼科领域。
信达生物国内在研双抗
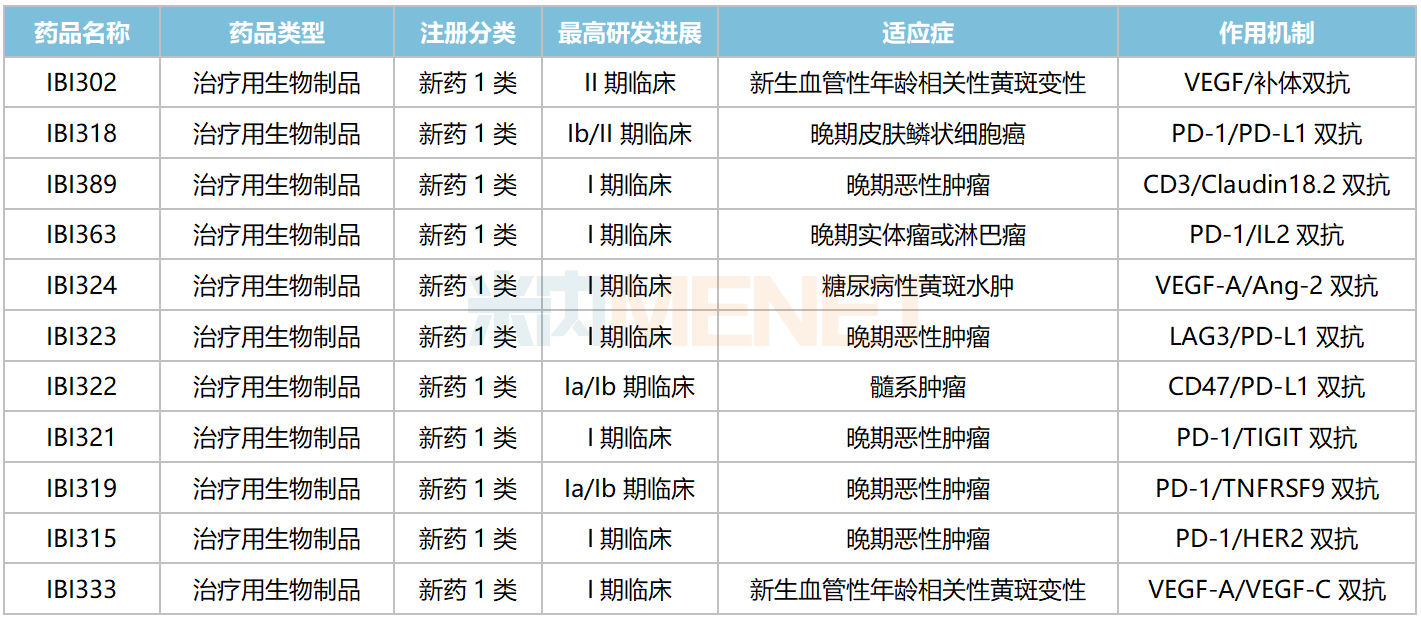
来源:米内网中国临床试验数据库
信达生物在研双抗在国内均无同类产品获批上市,PD-1/PD-L1双抗IBI318、VEGF/补体双抗IBI302均已步入II期(含Ib/II期)临床,分别用于治疗晚期皮肤鳞状细胞癌、新生血管性年龄相关性黄斑变性。
米内网数据显示,目前全球有9款双抗药物获批上市,2021年全球合计销售规模接近40亿美元,其中罗氏的艾美赛珠单抗以30.22亿瑞士法郎的销售额一骑绝尘。有数据预测显示,随着越来越多的创新双抗进入市场,同时已上市双抗获批更多适应症,双抗的全球市场规模在2025年将超过500亿元。
全球已获批上市的双抗药物
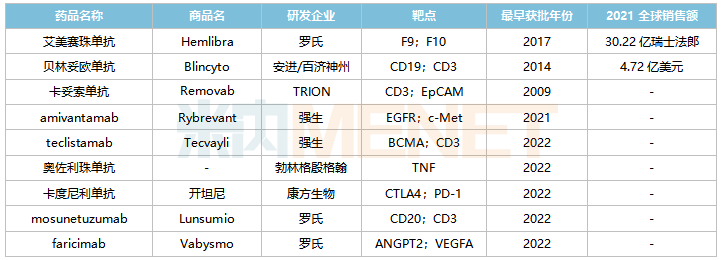
来源:米内网综合数据库
目前罗氏的艾美赛珠单抗(2018/11)、安进/百济神州的贝林妥欧单抗(2020/11)及康方生物的卡度尼利单抗(2022/6)已在国内获批,其中艾美赛珠单抗、贝林妥欧单抗2021年在中国三大终端6大市场(统计范围详见本文末)的销售额增速分别达13.7%、187.6%。
CAR-T产品上市可期
嵌合抗原受体T细胞免疫疗法(CAR-T疗法)是一种治疗肿瘤的新型精准靶向疗法,由于疗效数据优异,甚至能“治愈”癌症,一跃成为资本关注的焦点。
目前信达生物已有2款CAR-T产品步入临床阶段,其中与驯鹿生物合作开发的伊基仑赛注射液(IBI326)已提交上市申请,这是国内第一款全流程自主研发的CAR-T产品,也是国内首家报产的靶向BCMA的CAR-T产品。
信达生物在研的CAR-T产品
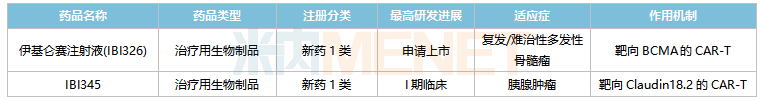
来源:米内网中国临床试验数据库
米内网数据显示,目前全球有8款CAR-T产品获批上市,2021全球合计销售规模超过17亿美元,其中有6款CAR-T产品靶向CD19,该类产品的混战正在持续加剧。
全球已获批上市的CAR-T产品
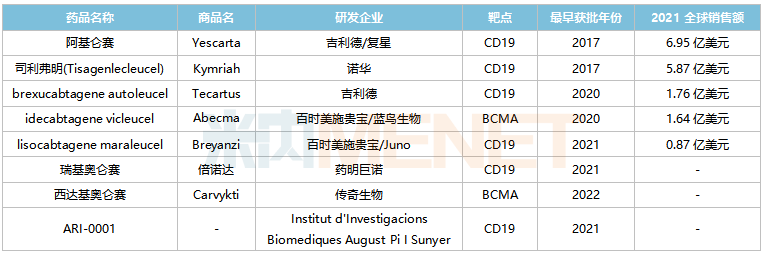
来源:米内网综合数据库
国内已获批的CAR-T产品包括吉利德/复星的阿基仑赛(2021/6)、药明巨诺的瑞基奥仑赛(2021/9),其中阿基仑赛预计2022E在中国城市实体药店终端的销售额将突破2亿元。根据弗若斯特沙利文的资料,预计2021-2025年,中国CAR-T疗法市场规模(以成本价计)复合年增长率将超过150%。伴随更多产品的获批,预计2030年将达到289亿元。
首款自主研发ADC新药亮相
抗体偶联药物(ADC)由抗体、连接子和毒素三部分偶联而成,通过多样“组合”迭代出新的产品。正因为如此,ADC药物有“生物导弹”之称,被业界认为或将成为下一个平台级产品。
2022年8月,信达生物与赛诺菲达成多项目合作与许可协议,以开展两款高潜力抗肿瘤药物SAR408701(CEACAM5 ADC)及SAR444245(非α偏向性IL-2)在中国的临床开发及商业化。
目前SAR408701注射液(IBI126)已在国内开展III期临床,用于治疗转移性非鳞状非小细胞肺癌。这是一款靶向CEACAM5的ADC药物,国内暂无同类药物获批,IBI126研发进展最快。
2022年10月,信达生物以新药1类提交的IBI343临床申请获得CDE承办受理,2022年底获批临床,日前已启动I期临床。这是信达生物自主研发的首款ADC药物,以claudin18.2(CLDN18.2)为靶点,该靶点已成为全球药企竞相布局的热门靶点。
信达生物国内在研的ADC药物
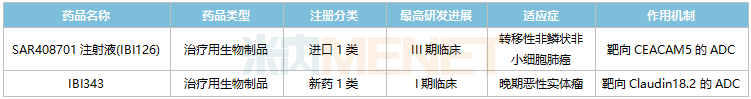
来源:米内网中国临床试验数据库
米内网数据显示,目前全球有16款ADC药物(不含生物类似药)获批上市,2021全球合计销售规模超过52亿美元。根据Natrue子刊的市场预测,2026年全球ADC药物市场规模将达到164亿美元。
全球已获批上市的ADC药物
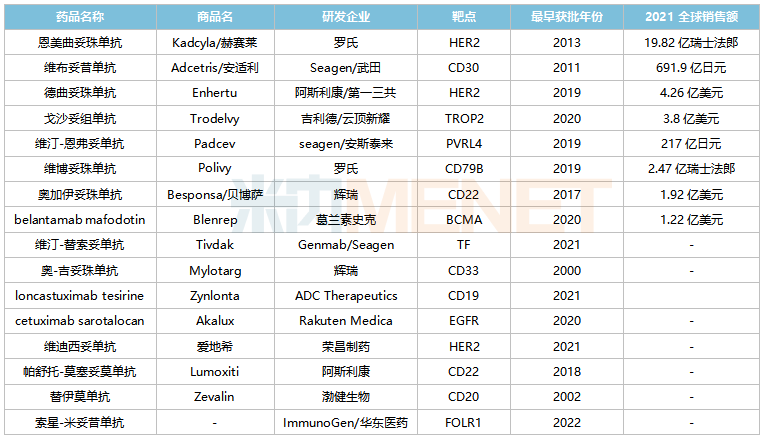
来源:米内网综合数据库
而在国内市场,已有多款ADC药物获批上市,包括辉瑞的奥加伊妥珠单抗(2021)、罗氏的恩美曲妥珠单抗(2020)、武田的维布妥昔单抗(2020)、吉利德/云顶新耀的戈沙妥组单抗(2022)及荣昌生物的维迪西妥单抗(2021),其中恩美曲妥珠单抗、维布妥昔单抗2021年在中国三大终端6大市场销售额分别接近3亿元及超过1亿元,增长率分别为102.9%、210.8%。
3个重磅单抗紧盯$90亿市场
除了1类新药,信达生物也布局改良新药及生物类似药。
目前信达生物已有3款生物类似药获批上市,分别为贝伐珠单抗、阿达木单抗及利妥昔单抗,3款产品在2021年中国三大终端6大市场合计销售规模接近150亿元。
信达生物国内在研的非1类新药
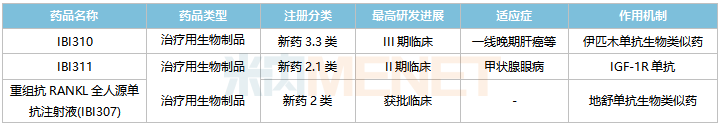
来源:米内网中国临床试验数据库
3款重磅单抗在国内处于获批临床及以上阶段。正在开展III期临床的IBI310为抗CTLA-4单抗,是伊匹木单抗生物类似药,原研产品2021年全球销售额达20.26亿美元;正在开展I期临床的IBI311属于IGF-1R单抗,原研产品为Tepezza,2021年全球销售额达16.6亿美元;已获批临床的重组抗RANKL全人源单抗注射液(IBI307)为地舒单抗生物类似药,原研产品2021年全球销售额超过50亿美元。
信达生物国内在研新药
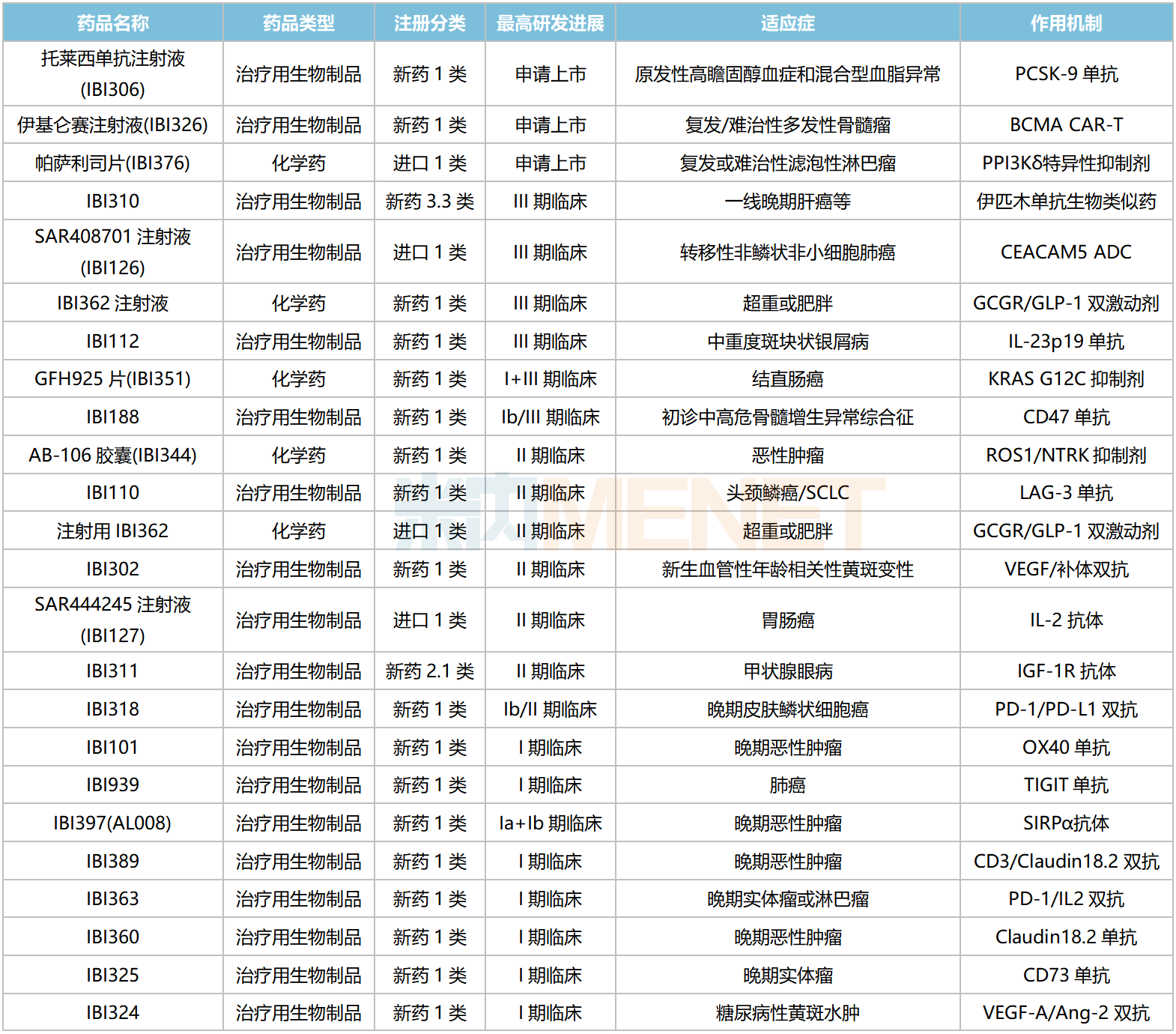
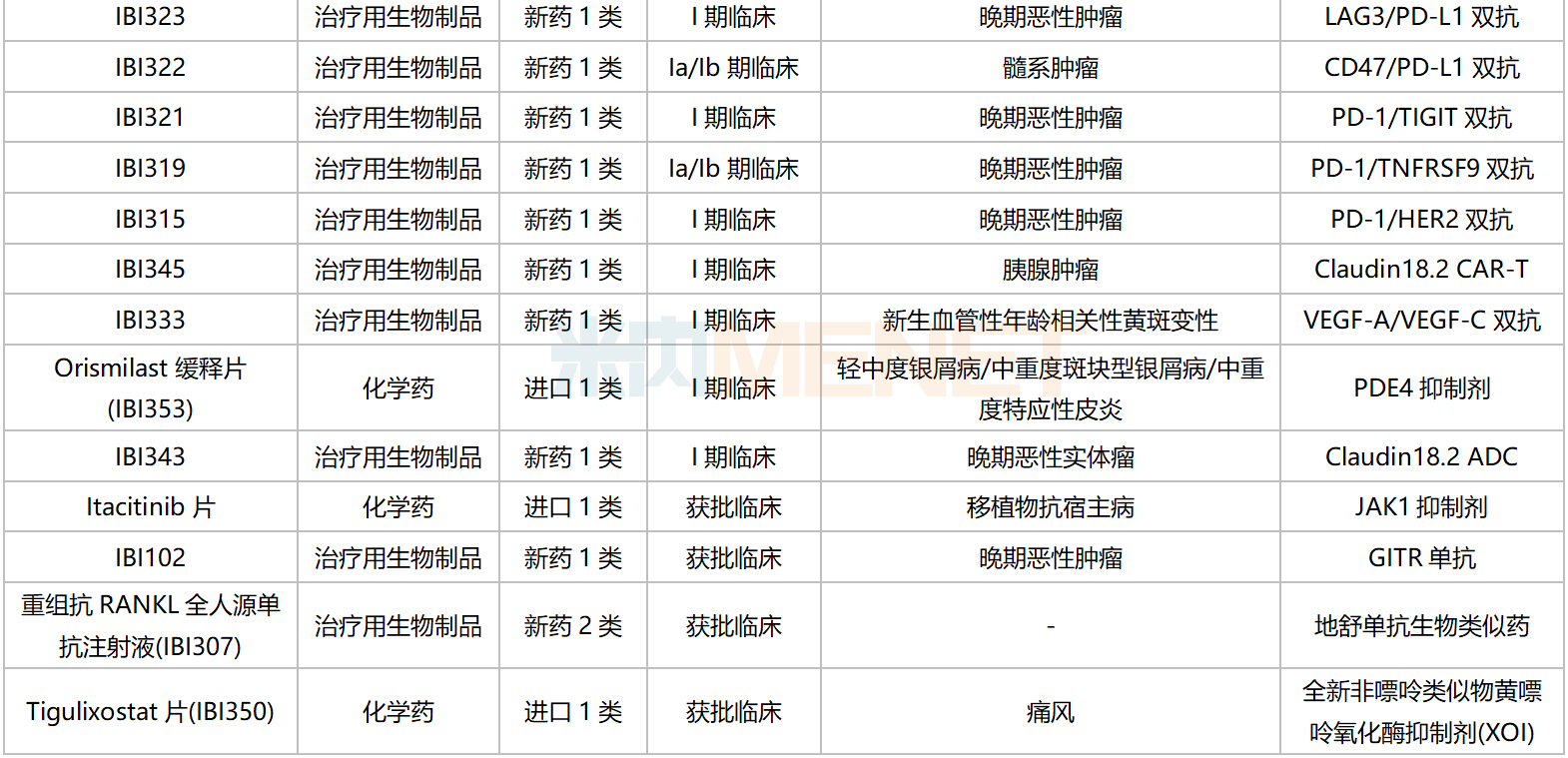
资料来源:米内网数据库等
分享:

本文地址:http://www.bx9y.com/dujia/2023-02-11/649891.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理





